LATIHAN 8
1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . .
a. Meningkatkan [H+] bila dimasukkan kedalam H2O
b. Menurunkan [H+] bila dimaasukkan kedalam H2O
c. Meningkatkan [OH–] bila dimasukkan kedalam H2O
d. Menerima 1 H+ dari pasangan reaksinya
e. Memberi 1 H+ dari pasangan reaksinya
Pembahasan:
Teori asam Brosnted-Lowry:
- Asam: zat yang memberikan 1 H+ pada pasangan reaksinya.
- Basa: zat yang menerima 1 H+ dari pasangan reaksinya.
Jawaban: E
2. Kertas lakmus biru akan berubah menjadi merah, bila dimasukkan ke dalam larutan…
a. Kalium hidroksida
b. Natrium klorida
c. Barium sulfat
d. Asam klorida
e. Natrium nitrat
Pembahasan:
Kertas lakmus adalah kertas yang diberi suatu senyawa kimia sehingga akan menunjukkan warna yang berbeda setelah dimasukkan pada larutan asam maupun basa.
Warna kertas lakmus akan berubah sesuai dengan larutannya. Kertas lakmus biru akan berubah menjadi merah bila dimasukkan kedalam larutan asam klorida, karena asam klorida merupakan asam kuat.
Jawaban: D
3. Untuk mengukur derajat keasaman asam atau basa yang akurat, paling tepat menggunakan. . . .
a. Fenolftalein
b. Metil jingga
c. pH meter
d. Bromtimol biru
e. Universal
Pembahasan:
pH meter adalah alat pengukur pH dengan ketelitian yang sangat tinggi. pH meter dapat menyatakan pH larutan sampai dua angka desimal pada suhu tertentu.
Jawaban: C
4. Reaksi yang tidak menghasilkan gas adalah . . . .
a. Logam magnesium dengan asam klorida encer
b. Natrium karbonat padat dengan asam sulfat encer
c. Logam besi dengan asam sulfat encer
d. Amonium klorida dengan natrium hidroksida
e. Logam tembaga dengan asam klorida encer
Pembahasan:
Cu tidak bereaksi dengan HCl karena Cu terletak disebelah kanan H dalam deret volta. Logam-logam yang terletak disebelah kanan H dalam deret volta bersifat mulia atau setengah mulia.
Logam setengah mulia seperti Cu hanya larut dalam asam oksidator( asam sulfat pekat, asam nitrat pekat dan asam nitrat encer ) sedangkan logam mulia seperti emas dan platina hanya larut dalam campuran HCl pekat dan asam nitrat pekat.
Jawaban: E
KUIS 8
BAB 13
1. Tetapan kesetimbangan dari reaksi SnO2 + 2H2(g) ⇔ Sn(s) + 2H2O(l) adalah ….
- Kc = [H2O]2/[H2]2
- Kc = [Sn][H2O]2/[Sn][H2]2
- Kc = [Sn]/[SnO2]
- Kc = [2H2O]/[2H2]
- Kc = [H2O]2/[SnO2] [H2]2
Pembahasan:
Reaksi kesetimbangan tersebut adalah reaksi kesetimbangan heterogen. Dalam reaksi tersebut terdapat fase padat dan gas, yang menentukan tetapan kesetimbangan adalah fase gas.
Jadi, Kc = [H2O]2/[H2]2
Jawaban : a
2. Suatu reaksi Ag2CrO2(s) ⇔ 2Ag+(aq) + CrO42-(aq)
Maka tetapan kesetimbangan dinyatakan sebagai ….
- Kc = [Ag+]2[CrO42-]/[ Ag2+ CrO42-]
- Kc = [CrO42-]/[ Ag+]2
- Kc = [Ag+]2/[ Ag2 CrO4]
- Kc = [Ag2CrO4]/[ Ag+]2[CrO42-]
- Kc = [Ag+]2[CrO42-]
Pembahasan:
Nilai tetapan kesetimbangan reaksi tidak dipengaruhi oleh fase padat (s) dan fase cair (l). Jadi, dari reaksi tersebut diperoleh, Kc = [Ag+]2[CrO42-].
Jawaban : e
BAB 14
1. Suatu sistem reaksi dalam keadaan setimbang bila…
a. Reaksi berlangsung dua arah pada waktu bersamaan
b. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
c. Jumlah mol zat yang ada pada keadaan setimbang selalu sama
d. Masing-masing zat yang bereaksi sudah habis
e. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
Pembahasan:
Kesetimbangan dinamis yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Proses kesetimbangan dinamis ini dapat terjadi pula dalam suatu reaksi kimia.
Jawaban : B
2. Rumusan tetapan kesetimbangan untuk reaksi :

Pembahasan :
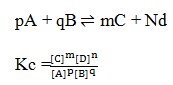
Hukum kesetimbangan yaitu bila suatu reaksi dalam keadaan setimbang, mak hasil kali konsentrasi zat-zat hasil reaksi dipangkatkan koefisiennya dibagi dengan hasil kali konsentrasi zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga tetap. Jika reaksi itu dalam wujud solid dan liquid maka diabaikan.
Jawaban : E
BAB 16
1. Gas N2 dengan volume 10 ml direaksikan dengan 25 ml gas H2, membentuk reaksi setimbang:
![]()
Volume akhir pada saat setimbang tercatat 25 ml (diukur pada P dan T yang sama). Volum gas NH3 yang terjadi pada saat setimbang adalah…
a. 5 ml
b. 10 ml
c. 15 ml
d. 35 ml
e. 40 ml
Pembahasan :
Diketahui :
V = 10 ml
Vt = 25 ml
V H2 = 25 ml
Dengan menggunakan perbandingan koefisien maka :
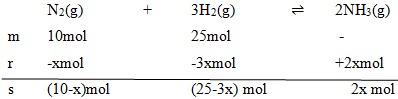
Vt = 25 ml
(10-x) + (25-3x) + 2x = 25
35 – 2x = 25
35 – 25 = 2x
10 = 2x
x = 5
jadi saat setimbang volume gas NH3 yaitu 2x = 2 . 5 = 10 ml
Jawaban : B
2. Dalam ruang 1 liter terdapat 1 mol gas HI yang terurai menurut reaksi:
![]()
Harga Kc pada saat itu adalah 4, jumlah gas H2 yang ada pada saat setimbang adalah…
a. 0,8 mol
b. 0,6 mol
c. 0,5 mol
d. 0,4 mol
e. 0,2 mol
Pembahasan :
Diket : V = 1 liter
Kc = 4
Mol HI = 1
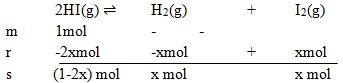
Jadi untuk Mencari Kc :
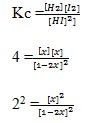
2 – 4x = x
2 = 5x
x = 0,4 mol
Jawaban : D
BAB 17
1. lapisan udara yang menyelubungi bumi disebut….
a. atmosfer
b. hidrosfer
c. litosfer
d. barisfer
e. Biosfer
Jawab : A
2. lapisan atmosfer paling bawah dalah….
a. Ionosfer
b. troposfer
c. termosfer
d. stratosfer
e. dissipasisfer
Jawab : B
BAB 18
1. Jika reaksi antara logam Barium dengan Asam Klorida encer di campurkan ked alam tabung reaksi yang tersumbat dengan rapat, gas Hidrogen di dalam sistem tidak dapat meninggalkan sistem. Akan tetapi perambatan kalor meninggalkan sistem tetap terjadi melalui dinding pada tabung reaksi. Pada percobaan ini termasuk ke dalam…
a. Sistem terbuka
b. Perubahan entalpi
c. Sistem tertutup
d. Perubahan energy dalam
e. Sistem terisolasi
Jawaban: C
Pembahasan: Pada percobaan tersebut termasuk ke dalam sistem tertutup, karena pada percobaan tersebut dapat terjadi perpindahan kalor yang di tandai dengan keluarnya kalor pada dinding tabung reaksi. Sedangkan gas Hidrogen yang bertindak sebagai materi tidak dapat meninggalkan sistem.
2. Pernyataan di bawah ini yang termasuk ke dalam reaksi Endoterm adalah…..
a. Besi berkarat
b. Pembuatan es batu dan air
c. Air mengalir
d. Ledakan bom
e. Pembakaran kayu
Jawaban: B
Pembahasan: Jika suatu reaksi kimia dengan sistem menyerap kalor lingkungannya maka di sebut dengan reaksi endoterm. Pada pembuatan es batu dan air terjadi kenaikan energy potensial zat-zat yang bereaksi/terjadi penurunan energy kinetic sehingga suhu sistem turun.





Tidak ada komentar:
Posting Komentar